LES ALCYNES H R C C R C C R' acétyléniques disubstitués ou alcynes internes acétyléniques vrais ou alcynes terminaux...
Extrait du document
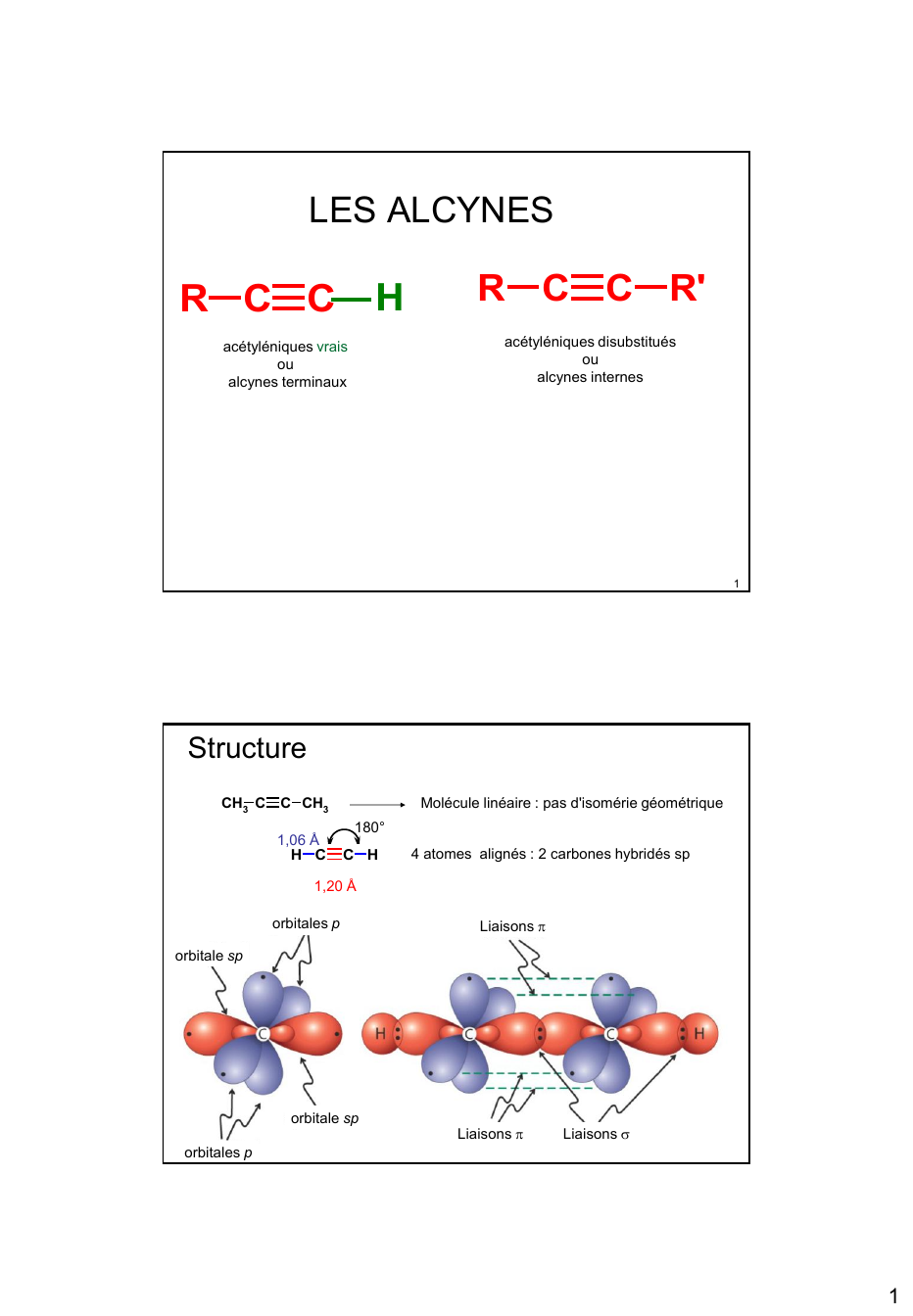
« LES ALCYNES H R C C R C C R' acétyléniques disubstitués ou alcynes internes acétyléniques vrais ou alcynes terminaux 1 Structure CH3 C C CH3 1,06 Å H C Molécule linéaire : pas d'isomérie géométrique 180° C H 4 atomes alignés : 2 carbones hybridés sp 1,20 Å orbitales p Liaisons orbitale sp orbitale sp Liaisons Liaisons 2 orbitales p 1 liaisons H C C H longueur Énergie des liaisons C C 1, 20 Å 50% de caractère s ~ 835 KJ C C 1, 34 Å 33% de caractère s ~ 600 KJ C C 1, 54 Å 25% de caractère s ~ 350 KJ La liaison C-H est également plus courte car impliquant une orbitale sp Δ ~ 235 ~ 250 1,06 Å Stabilité Alcynes : présence de 4 électrons π dans un volume petit liaisons π relativement faibles, molécules très énergétiques Comme pour les alcènes, Un alcyne terminal est moins stable qu’un alcyne interne (hyperconjugaison) 3 Propriétés Chimiques communes à tous les alcynes Additions sur la triple liaison Hydrogénation 2 liaisons : peuvent additionner une ou deux moles H 2 catalytique : R C C R' H H R C C Ni Raney, Pd, Pt,... H H H2 R' la deuxième liaison étant plus stable, arrêt possible à l'alcène cis R C C H2 R' catalyseur de Lindlar Action du diborane R' R C C H Pd/CaCO3/ Pb(OAc)2 quinoléine H syn-addition Comme avec les alcènes : action de B2H6 puis hydrolyse acide obtention de l'alcène cis 4 2 Action des Hydracides R C C H R HCl + C H R H Cl H C C C PVC H n Formation du carbocation le moins instable Effet inducteur attracteur du chlore : réactivité diminuée Régiosélectivité de la deuxième addition : H R C Cl H C H C H + Cl H H R C C Cl H H H + H C C Cl C Cl H H + H C H Cl R C < R + Cl H R 6 De même, addition de H+ CN-, CH3COO-, H+, HOCl, … A- H+ Addition de CH3COOH : H3C OH + H3C C O C CH H + H3C C C H O H3C C O CH3 O C H3C CH2 C O Ester d'énol N Addition de HCN C H3C C CH + HC N H3C C CH ... H A H3C C CH + A H H3C C CH H 7 3 ou si le nucléophile n'est pas suffisamment acide + catalyseur acide fort… Exemple : addition d'eau en milieu acide (catalyse par Hg 2+/ H2S04) 2+ Hg + H / + R H R H2O R C C H C H C C H H O + n R C H + H C C H H O + H H.... »
↓↓↓ APERÇU DU DOCUMENT ↓↓↓