ED1 Enzymologie PACES
Publié le 03/04/2019

Extrait du document

e graphique ci-dessous est la représentation linéaire de Lineweaver-Burk après transformation algébrique de l'équation de Michaelis -Menten.
1. Indiquer dans l'ordre :
- la réaction sans inhibiteur avec concentration [E] d'enzyme
- la réaction avec inhibiteur compétitif avec concentration [E] d'enzyme
- la réaction avec inhibiteur non compétitif avec concentration [E] d'enzyme
- la réaction sans inhibiteur avec concentration 2X[E] d'enzyme
2. Schématiser la représentation prévisible des résultats des différentes réactions selon l'équation de Michaelis-Menten (Vi= f([S])).
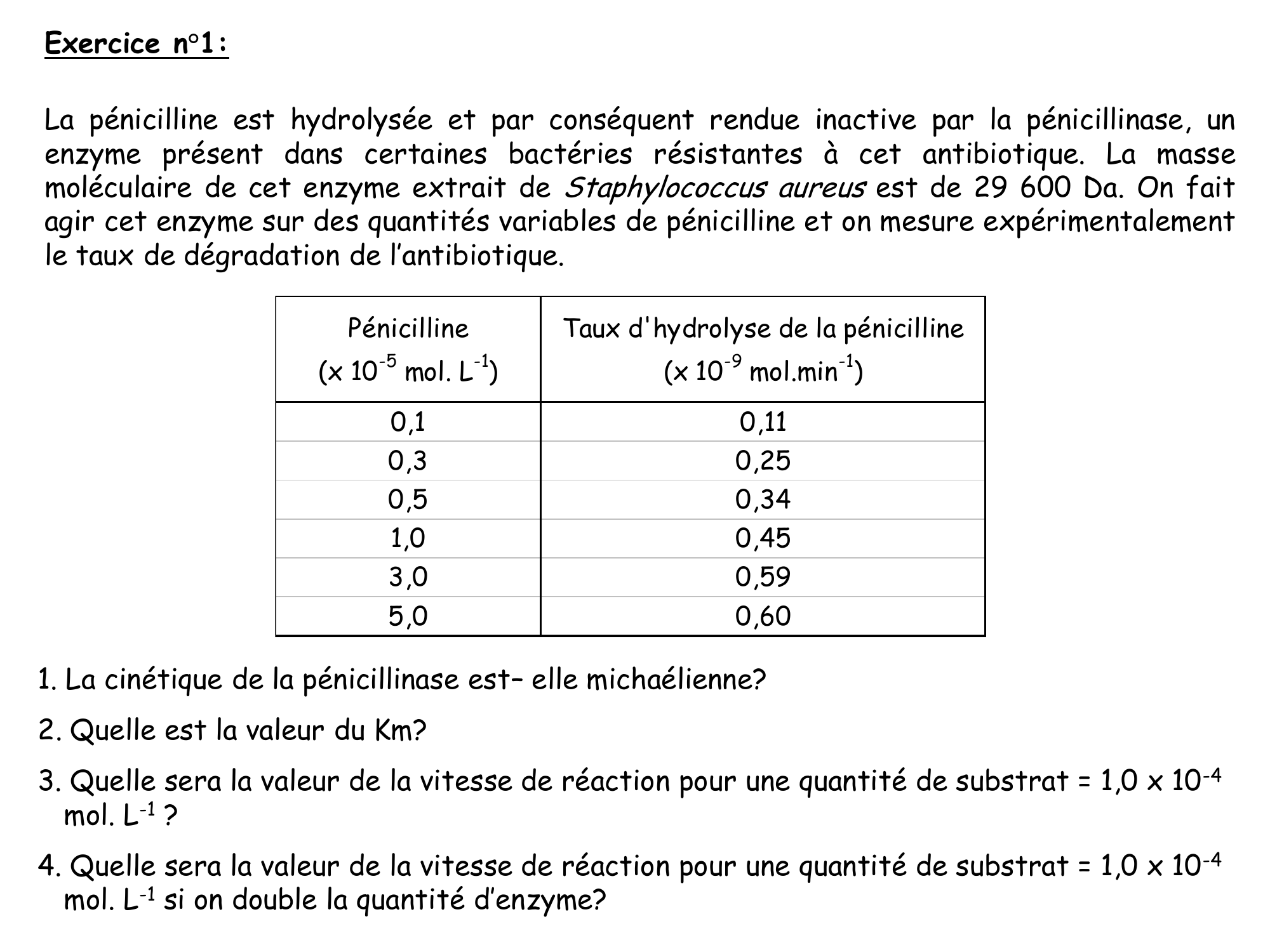
Exercice n°1:
La pénicilline est hydrolysée et par conséquent rendue inactive par la pénicillinase, un enzyme présent dans certaines bactéries résistantes à cet antibiotique. La masse moléculaire de cet enzyme extrait de Staphylococcusaureus est de 29 600 Da. On fait agir cet enzyme sur des quantités variables de pénicilline et on mesure expérimentalement le taux de dégradation de l'antibiotique.
Pénicilline (x 10-5 mol. L-1) T aux d'h ydro l y se de la pénicilline (x 10-9 mol.min-1)
0,1 0,11
0,3 0,25
0,5 0,34
1,0 0,45
3,0 0,59
5,0 0,60
1. La cinétique de la pénicillinase est- elle michaélienne?
2. Quelle est la valeur du Km?
3. Quelle sera la valeur de la vitesse de réaction pour une quantité de substrat = 1,0 x 10-4 mol. L-1 ?
4. Quelle sera la valeur de la vitesse de réaction pour une quantité de substrat = 1,0 x 10-4 mol. L-1 si on double la quantité d'enzyme?
Combien de fois faut-il augmenter la concentration en substrat pour passer d'une vitesse de réaction de 0,1 Vmax à 0,9 Vmax pour une enzyme suivant le modèle de Michaelis -Menten ?
A. 9fois
B. 18fois
C. 81 fois
D. 162 fois

«
Exercice n°1:
La pénicilline est hydrolysée et par conséquent rendue inactive par la pénicillinase, un
enzyme présent dans certaines bactéries résistantes à cet antibiotique . La masse
moléculaire de cet enzyme extrait de Staphylococcus aureus est de 29 600 Da . On fait
agir cet enzyme sur des quantités variables de pénicilline et on mesure expérimentalement
le taux de dégradation de l’antibiotique .
1. La cinétique de la pénicillinase est – elle michaélienne?
2.
Quelle est la valeur du Km?
3.
Quelle sera la valeur de la vitesse de réaction pour une quantité de substrat = 1,0 x 10 -4
mol.
L -1?
4.
Quelle sera la valeur de la vitesse de réaction pour une quantité de substrat = 1,0 x 10 -4
mol.
L -1si on double la quantité d’enzyme?Pénicilline
(x 10 -5 mol.
L -1)
Taux d'hydrolyse de la pénicilline
(x 10 -9 mol.min -1)
0,1 0,11
0,3 0,25
0,5 0,34
1,0 0,45
3,0 0,59
5,0 0,60.
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- ED1 Enzymologie PACES 2011-2012 Prévoir une calculatrice pour certains exercices PS: les calculatrices ne
- PACES 2011-2012 UE1 ED1 - Atome, Etats de la matière L'atome, généralités Exercice 1 Quel est le nombre de protons, neutrons et d'électrons présents dans chacun des atomes et ions suivants ?
- QUESTIONS-REPONSES ED1-PACES 2011-2012 1) Existe t-il des protéines ayant les deux domaines N et C ter intracellulaires (ou extracellulaires) avec une hélice alpha dans la membrane (mais qui donc ne traverserait pas la membrane) ?
- ED1 Enzymologie
- QUESTIONS-REPONSES ED1-PACES 2011-2012 (annales)