Configuration des monosaccharides
Publié le 30/05/2015

Extrait du document
la zone 0,05 — 10 s
On a pu mesurer k0 et kf dans un certain nombre de cas
«
Le glucose 5
Ainsi le pouvoir rotatoire d’une solution aqueuse de l’isomère a-D, qui cor-
respond
à [a]iO + 112” immédiatement après la dissolution décroît-il en quelques
heures jusqu’à la valeur 52,7”.
Réciproquement le pouvoir rotatoire de l’isomère
0-D croît de 18,7”, valeur à la dissolution jusqu’à la même valeur d’équilibre.
Une
règle de mélange permet de calculer
[a]/[fl = 38/62.
Le composé tout équatorial
domine, mais nous verrons au paragraphe
2.6 qu’il faut s’abstenir d’y voir la
confirmation des règles de l’analyse de conformation classique.
Ce sont ces expé-
riences qui ont permis la première observation de l’équilibre tautomérique
(1.1)
qui, pour cette raison, a gardé le nom de mutarotation.
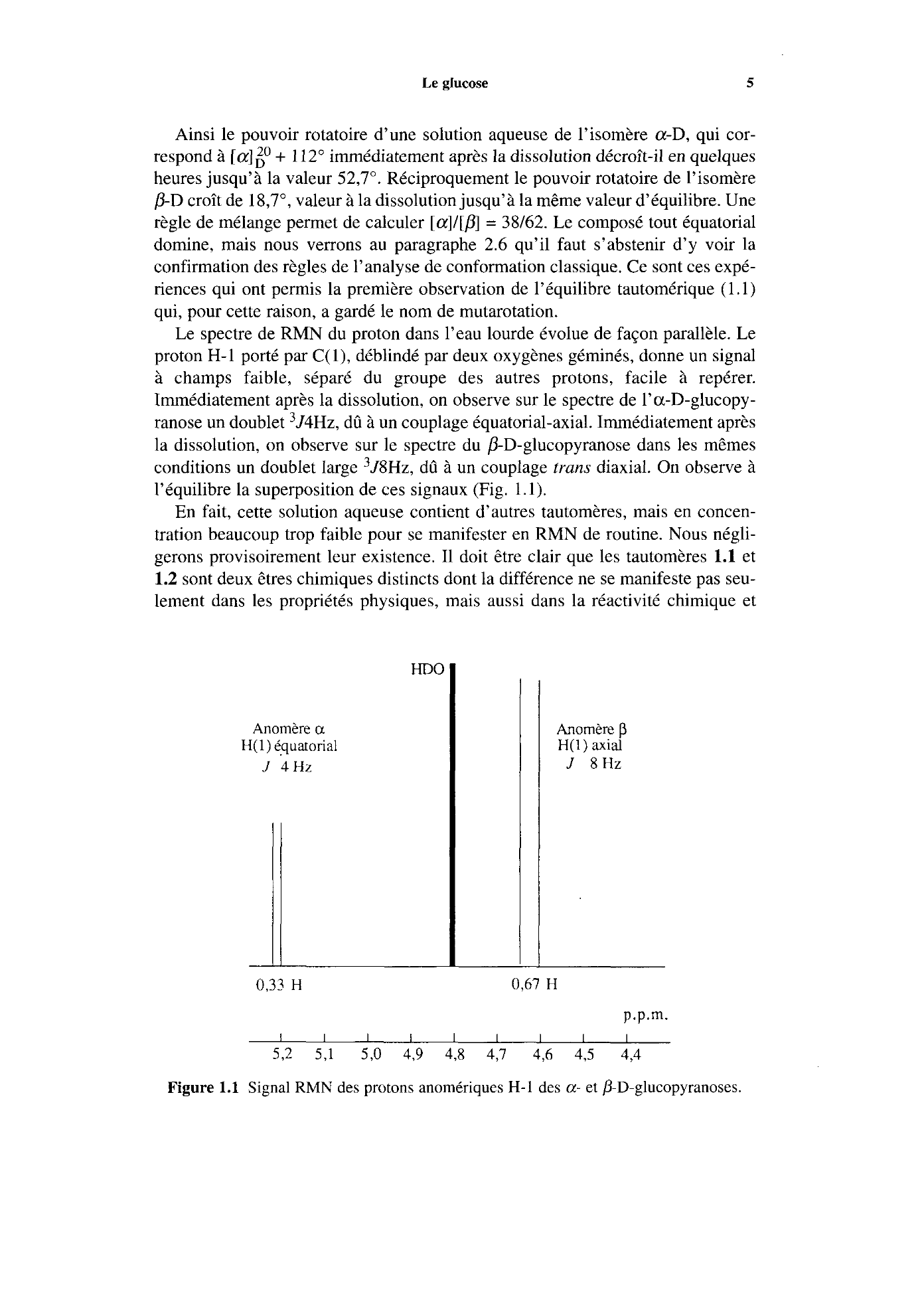
Le spectre de RMN du proton dans l’eau lourde évolue de façon parallèle.
Le
proton H-1 porté par
C( l), déblindé par deux oxygènes géminés, donne un signal
à champs faible, séparé du groupe des autres protons, facile à repérer.
Immédiatement après la dissolution,
on observe sur le spectre de l’a-D-glucopy-
ranose un doublet 3J4Hz, dû
à un couplage équatorial-axial.
Immédiatement après
la dissolution, on observe sur le spectre du 0-D-glucopyranose dans les mêmes
conditions un doublet large
3J8Hz, dû à un couplage trans diaxial.
On observe à
l’équilibre la superposition de ces signaux (Fig.
1.1).
En fait, cette solution aqueuse contient d’autres tautomères, mais en concen-
tration beaucoup
trop faible pour se manifester en RMN de routine.
Nous négli-
gerons provisoirement leur existence.
I1 doit être clair que les tautomères
1.1 et
1.2 sont deux êtres chimiques distincts dont la différence ne se manifeste pas seu-
lement dans les propriétés physiques, mais aussi dans la réactivité chimique et
1
Anomère a H(l)é.quatonal
J 4HZ
0,3? H
Anomère p H(l) axial
J 8Hz
0,67 H
p.p.m.
I I I I I I I I I 5,2 5,l 5,O 4,9 4,8 4,7 4,6 43 4,4
Figure 1.1 Signal RMN des protons anomériques H-1 des a- et fi-D-glucopyranoses..
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- MATHEMATIQUES - GEOMETRIE THÉORÈME DE THALÈS - THÉORÈME DE PYTHAGORE Théorème de Thalès Configuration de Thalès Figure formée de droites parallèles et de droites sécantes.
- Premier secteur du continent noir, abordé dès le XV° siècle, puis exploité par les Européens, l'Afrique occidentale a été artificiellement divisée en colonies dont le découpage politique survit dans la configuration des Etats actuels.
- configuration (informatique) - informatique.
- Vocabulaire: CONFIGURATION, substantif féminin.
- Ses clients potentiels visitent son site, choisissent la configuration de leur PC et passent leur commande.