Agua - ciencia y tecnologia.
Publié le 27/05/2013

Extrait du document
«
4 EL AGUA EN LA VIDA
El agua es el componente principal de la materia viva.
Constituye del 50 al 90% de la masa de los organismos vivos.
El protoplasma, que es la materia básica de las célulasvivas, consiste en una disolución de grasas, carbohidratos, proteínas, sales y otros compuestos químicos similares en agua.
El agua actúa como disolvente transportando,combinando y descomponiendo químicamente esas sustancias.
La sangre de los animales y la savia de las plantas contienen una gran cantidad de agua, que sirve paratransportar los alimentos y desechar el material de desperdicio.
El agua desempeña también un papel importante en la descomposición metabólica de moléculas tanesenciales como las proteínas y los carbohidratos.
Este proceso, llamado hidrólisis, se produce continuamente en las células vivas.
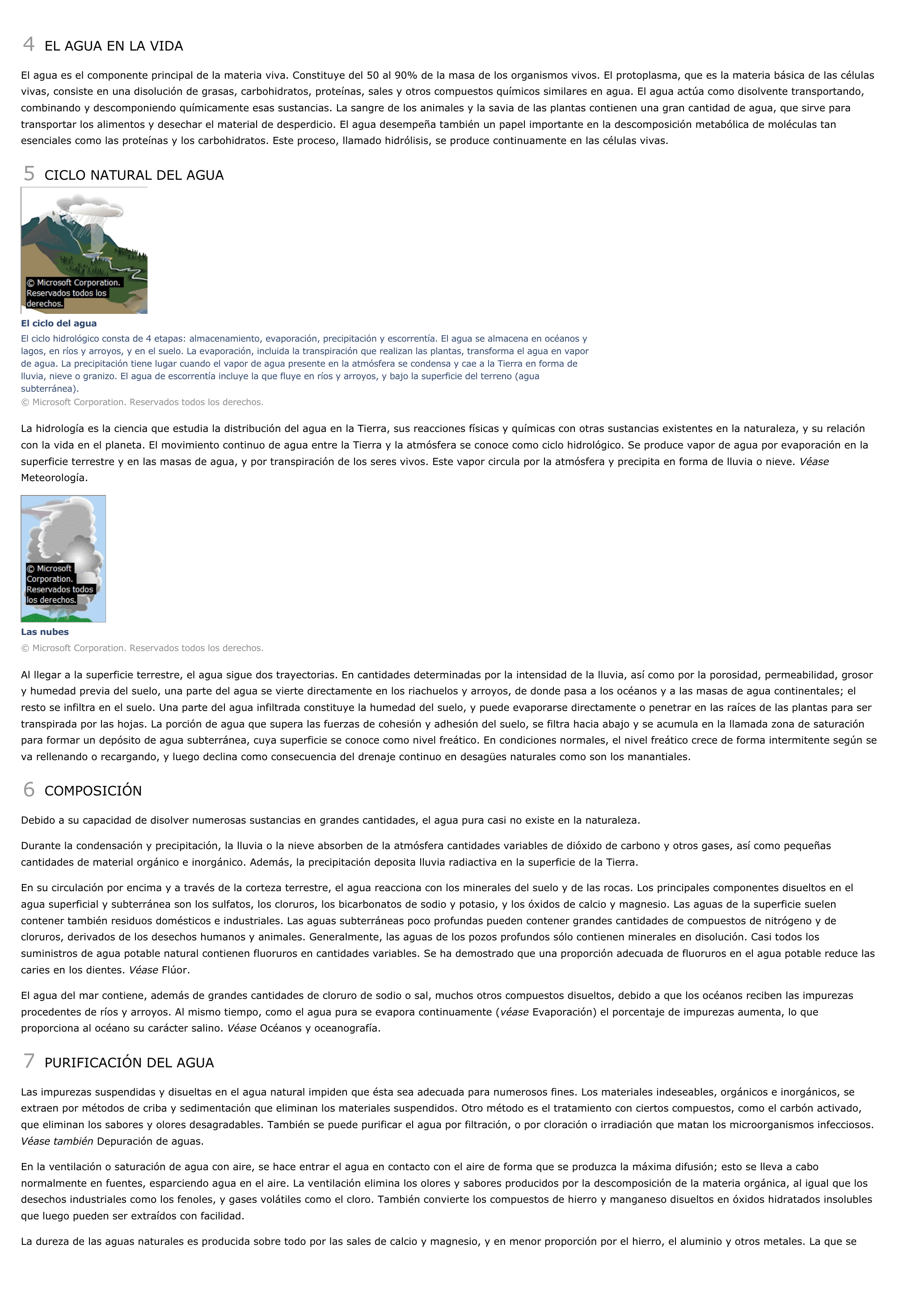
5 CICLO NATURAL DEL AGUA
El ciclo del aguaEl ciclo hidrológico consta de 4 etapas: almacenamiento, evaporación, precipitación y escorrentía.
El agua se almacena en océanos ylagos, en ríos y arroyos, y en el suelo.
La evaporación, incluida la transpiración que realizan las plantas, transforma el agua en vaporde agua.
La precipitación tiene lugar cuando el vapor de agua presente en la atmósfera se condensa y cae a la Tierra en forma delluvia, nieve o granizo.
El agua de escorrentía incluye la que fluye en ríos y arroyos, y bajo la superficie del terreno (aguasubterránea).© Microsoft Corporation.
Reservados todos los derechos.
La hidrología es la ciencia que estudia la distribución del agua en la Tierra, sus reacciones físicas y químicas con otras sustancias existentes en la naturaleza, y su relacióncon la vida en el planeta.
El movimiento continuo de agua entre la Tierra y la atmósfera se conoce como ciclo hidrológico.
Se produce vapor de agua por evaporación en lasuperficie terrestre y en las masas de agua, y por transpiración de los seres vivos.
Este vapor circula por la atmósfera y precipita en forma de lluvia o nieve.
Véase Meteorología.
Las nubes© Microsoft Corporation.
Reservados todos los derechos.
Al llegar a la superficie terrestre, el agua sigue dos trayectorias.
En cantidades determinadas por la intensidad de la lluvia, así como por la porosidad, permeabilidad, grosory humedad previa del suelo, una parte del agua se vierte directamente en los riachuelos y arroyos, de donde pasa a los océanos y a las masas de agua continentales; elresto se infiltra en el suelo.
Una parte del agua infiltrada constituye la humedad del suelo, y puede evaporarse directamente o penetrar en las raíces de las plantas para sertranspirada por las hojas.
La porción de agua que supera las fuerzas de cohesión y adhesión del suelo, se filtra hacia abajo y se acumula en la llamada zona de saturaciónpara formar un depósito de agua subterránea, cuya superficie se conoce como nivel freático.
En condiciones normales, el nivel freático crece de forma intermitente según seva rellenando o recargando, y luego declina como consecuencia del drenaje continuo en desagües naturales como son los manantiales.
6 COMPOSICIÓN
Debido a su capacidad de disolver numerosas sustancias en grandes cantidades, el agua pura casi no existe en la naturaleza.
Durante la condensación y precipitación, la lluvia o la nieve absorben de la atmósfera cantidades variables de dióxido de carbono y otros gases, así como pequeñascantidades de material orgánico e inorgánico.
Además, la precipitación deposita lluvia radiactiva en la superficie de la Tierra.
En su circulación por encima y a través de la corteza terrestre, el agua reacciona con los minerales del suelo y de las rocas.
Los principales componentes disueltos en elagua superficial y subterránea son los sulfatos, los cloruros, los bicarbonatos de sodio y potasio, y los óxidos de calcio y magnesio.
Las aguas de la superficie suelencontener también residuos domésticos e industriales.
Las aguas subterráneas poco profundas pueden contener grandes cantidades de compuestos de nitrógeno y decloruros, derivados de los desechos humanos y animales.
Generalmente, las aguas de los pozos profundos sólo contienen minerales en disolución.
Casi todos lossuministros de agua potable natural contienen fluoruros en cantidades variables.
Se ha demostrado que una proporción adecuada de fluoruros en el agua potable reduce lascaries en los dientes.
Véase Flúor.
El agua del mar contiene, además de grandes cantidades de cloruro de sodio o sal, muchos otros compuestos disueltos, debido a que los océanos reciben las impurezasprocedentes de ríos y arroyos.
Al mismo tiempo, como el agua pura se evapora continuamente ( véase Evaporación) el porcentaje de impurezas aumenta, lo que proporciona al océano su carácter salino.
Véase Océanos y oceanografía.
7 PURIFICACIÓN DEL AGUA
Las impurezas suspendidas y disueltas en el agua natural impiden que ésta sea adecuada para numerosos fines.
Los materiales indeseables, orgánicos e inorgánicos, seextraen por métodos de criba y sedimentación que eliminan los materiales suspendidos.
Otro método es el tratamiento con ciertos compuestos, como el carbón activado,que eliminan los sabores y olores desagradables.
También se puede purificar el agua por filtración, o por cloración o irradiación que matan los microorganismos infecciosos.Véase también Depuración de aguas.
En la ventilación o saturación de agua con aire, se hace entrar el agua en contacto con el aire de forma que se produzca la máxima difusión; esto se lleva a cabonormalmente en fuentes, esparciendo agua en el aire.
La ventilación elimina los olores y sabores producidos por la descomposición de la materia orgánica, al igual que losdesechos industriales como los fenoles, y gases volátiles como el cloro.
También convierte los compuestos de hierro y manganeso disueltos en óxidos hidratados insolublesque luego pueden ser extraídos con facilidad.
La dureza de las aguas naturales es producida sobre todo por las sales de calcio y magnesio, y en menor proporción por el hierro, el aluminio y otros metales.
La que se.
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Oxígeno - ciencia y tecnologia.
- Plomo - ciencia y tecnologia.
- Platino - ciencia y tecnologia.
- Plata - ciencia y tecnologia.
- Paladio (elemento) - ciencia y tecnologia.