Le couple ion ammonium / ammoniac
Publié le 08/09/2011

Extrait du document
On classe les couples acide-base par ordre croissant de la force de l'acide,
autrement dit. par ordre décroissant de la valeur du pKA.
«
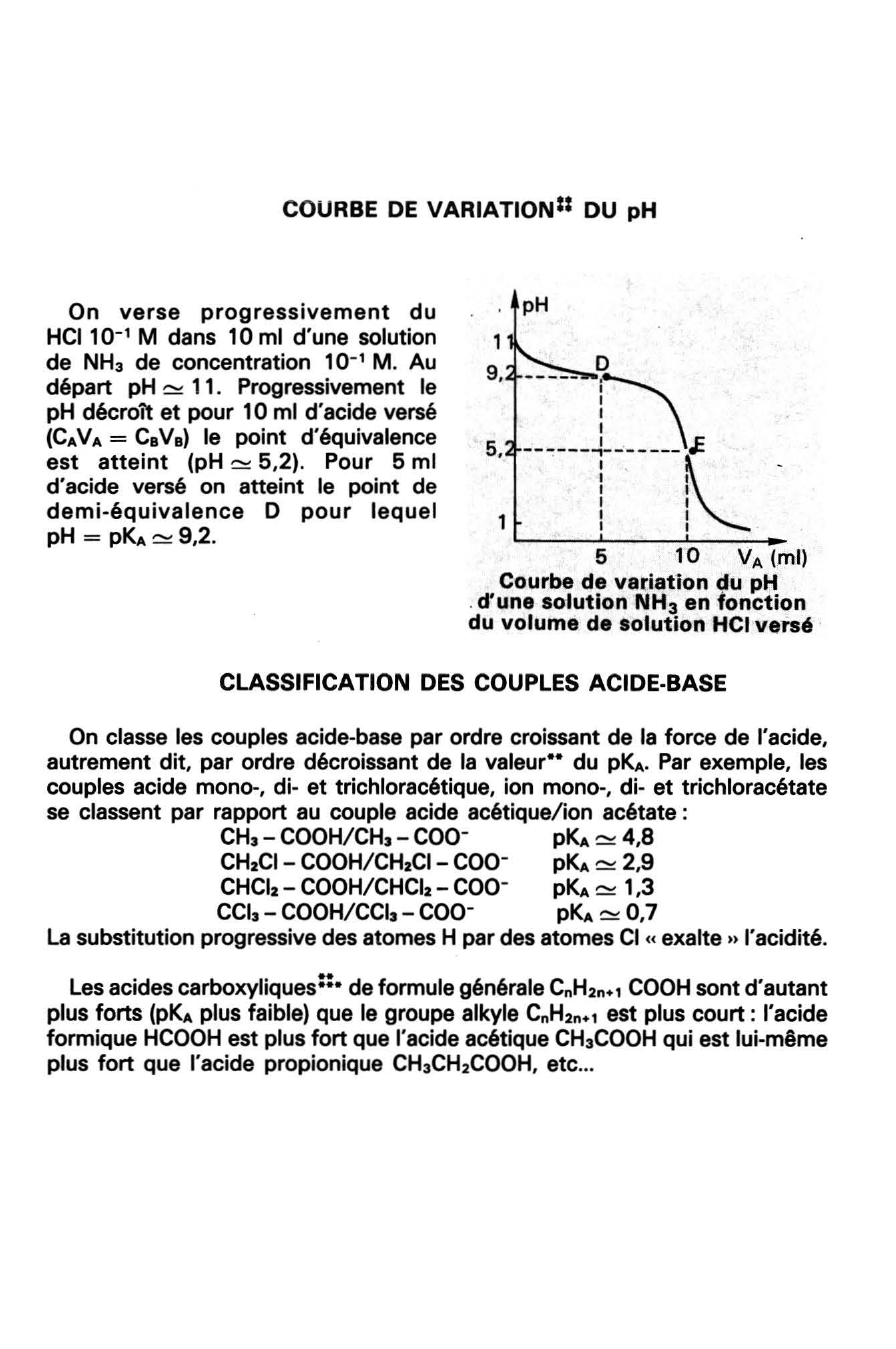
COURBE DE VARIATION=* DU pH
On verse progressivement du HCI10- 1 M dans 10
ml d'une solution
de NHa de concentration 10-1 M.
Au départ pH ~ 11.
Progressivement le pH décroît et pour 10 ml d'acide versé (CNA =CaVa) le point d'équivalence est atteint (pH ~ 5,2).
Pour 5 ml
d'acide versé on atteint le point de demi-équivalence D pour lequel pH = pKA ~ 9,2.
pH
9,
h 5
• ------l- -----~ l~ -
1 1 1 1
5 10 VA (ml)
Courbe de variation ~u pH .
d'une solution NH 3 en fonction du volume de solution HCI versé
CLASSIFICATION
DES COUPLES ACIDE-BASE
On classe les couples acide-base par ordre croissant de la force de l'acide, autrement dit.
par ordre décroissant de la valeur•• du pKA.
Par exemple, les
couples acide mono-.
di- et trichloracétique , ion mono-.
di-et trichloracétate se classent par rapport au couple acide acétique/ion acétate : CHs- COOH/CH s- COO · pKA ~ 4 ,8 CHaCI -COOH/CHzCI -COO· pKA ~ 2,9 CHCiz- COOH/CHCiz- COO- pKA ~ 1,3 CCis- COOH/CCio- COO- pKA ~ 0, 7 La substitution progressive des atomes H par des atomes Cl« exalte ..
l'acidité.
Les acides carboxyliques::.
de formule générale CnH2 n•1 COOH sont d'autant
plus forts (pKA plus faible) que le groupe alkyle CnH2n•1 est plus court : l'acide
formique HCOOH est plus fort que l'acide acétique CH3COOH qui est lui-même
plus fort que l'acide propionique CH3CH2COOH , etc ....
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Etude quantitative du couple acide acétique /ion acétate
- CALOMNIE (La) Ion Luca Caragiale (résumé & analyse)
- Prévenir la drépanocytose Lorsqu’un couple donne naissance à un enfant
- Mesure de couple
- ION, ou Sur l’Iliade, Platon - résumé de l'oeuvre