Les Alcènes Al 1 Stabilité des alcènes h? ou T°> 200°C Z( ) GENE STERIQUE E( ) Après isomérisation, la
Publié le 02/10/2014

Extrait du document
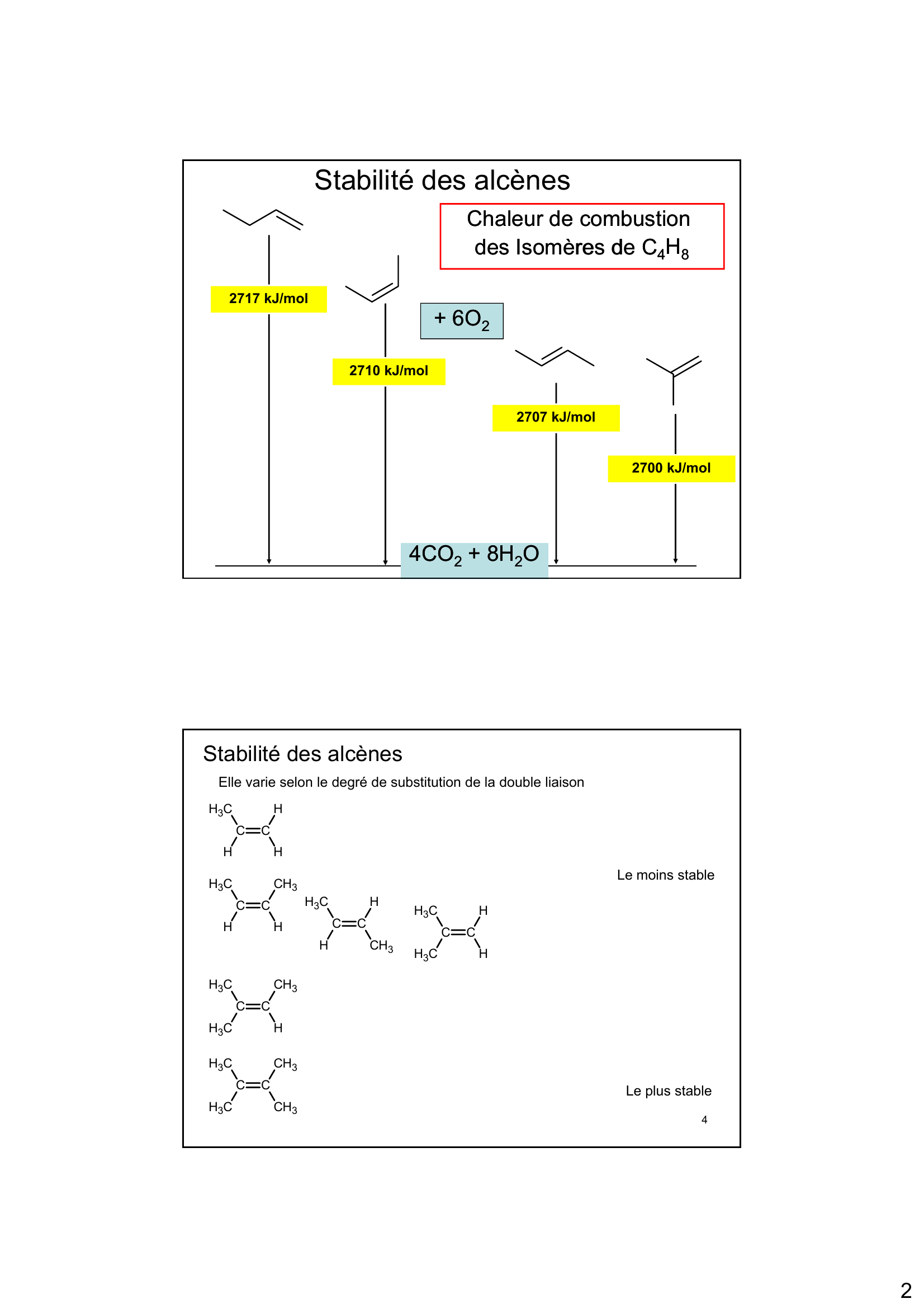
« 2 2717 kJ/mol Chaleur de combustion Chaleur de combustion des des IsomèresIsomères de Cde C 4 4H H 8 8 Stabilité des alcènes + 6O + 6O 2 2 2707 kJ/mol 2717 kJ/mol 2710 kJ/mol 4CO 4CO 2 2+ 8H + 8H 2 2O O 2700 kJ/mol Stabilité des alcènes Elle varie selon le degré de substitution de la double liaison CC C H 3 HHH CC C H 3 HHCH 3 CC C H 3 HCH 3 H CC C H 3 C H3 H H C C C H3 CH 3 Le moins stable 4 C C C H3 H CC C H 3 C H3 CH 3 CH 3 Le plus stable. »
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- grand oral chimie "stabilité du pH sanguin"
- ZEE (zone économique exclusive), espace maritime situé au-delà des eaux territoriales (à plus de 12 milles du rivage), dans le prolongement de ces dernières, et qui peut s'étendre jusqu'à 200 milles (environ 370 km) des côtes de l'État riverain.
- Tunney Gene, 1897-1978, né à New York, boxeur américain.
- Tierney Gene, 1920-1991, née à New York, actrice américaine.
- stabilité.