Les éthers 1 Les éthers O R O O R' R Ar Ar Ar' Dérivés disubstitués de l'eau, par des groupes alkyle
Publié le 02/10/2014

Extrait du document
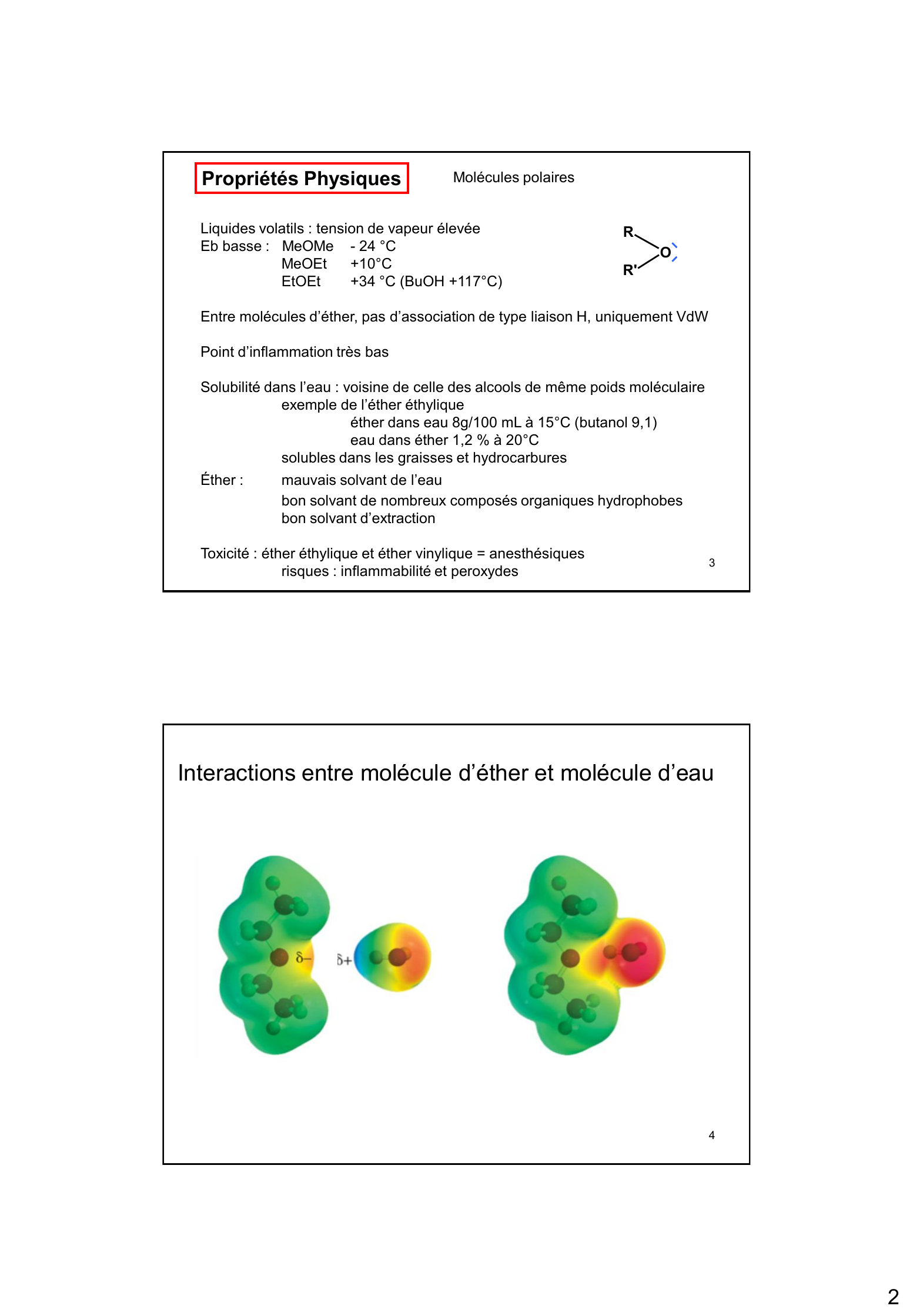
« 2 3 Propriétés Physiques Liquides volatils : tension de vapeur élevée Eb basse : MeOMe - 24 °C MeOEt +10 °C EtOEt +34 °C ( BuOH +117 °C) Entre molécules d’éther, pas d’association de type liaison H, uniquement VdW Point d’inflammation très bas Solubilité dans l’eau : voisine de celle des alcools de même poids moléculaire exemple de l’éther éthylique éther dans eau 8g/100 mL à 15 °C (butanol 9,1) eau dans éther 1,2 % à 20 °C solubles dans les graisses et hydrocarbures Éther : mauvais solvant de l’eau bon solvant de nombreux composés organiques hydrophobes bon solvant d’extraction Toxicité : éther éthylique et éther vinylique = anesthésiques risques : inflammabilité et peroxydes Molécules polaires 4 Interactions entre molécule d’éther et molécule d’eau R O R '. »
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Dérivés halogénés 1 Dérivés halogénés Halogénures d'Alkyle sp3 X = F, Cl, Br, I Halogénures de
- 15/10/2011 Dérivés des Acides Carboxyliques 1 Anhydride d'acide Chlorure d'acide O O O 107 1011 R Cl R Décomposé rapidement par l'eau à TA O CH3 Décomposé
- « L’eau est le principe de toutes choses » THALÈS DE MILET
- Comment peut-on rendre l’eau de mer potable?
- les enjeux de l'eau