Changements de configuration Sucres non saturés et ramifiés
Publié le 30/05/2015

Extrait du document
Les glycals sont des éthers d' énols et donnent lieu à des additions électrophiles. Avec un réactif dissymétrique, la partie électrophile s'additionne sur C(2), de façon à faire apparaître un ion oxocarbénium relativement stable en C(1). Ainsi l'eau, les alcools et les acides carboxyliques, en catalyse acide, donnent respectivement le sucre 2-désoxy (7.31, Z = OH), le glycoside 2-désoxy (7.31, Z = OR) et l'ester (7.31, Z = OCOR). Les conditions, qui catalysent aussi l'anomérisation, conduisent à l'anomère le plus stable. Les acides HC1 et HBr donnent les chlorures et bromures de 2-déoxyglycosyle (7.31, Z = Cl, Br). Chlore et brome donnent chacun les deux dérivés halogénés possibles, par exemple, à partir du tri-O-acétyl-D-glucal, a-D-gluco (7.32, 60 %) et a-D-manno (7.33, 30 %). Là encore, l'étape initiale, due à la molécule de brome ou au cation Br+ électrophiles engendre un cation oxocarbénium centré sur C(1), qui, en présence de sels d'argent, capte une molécule d'un solvant alcoolique, pour donner un a-glycoside, 2-bromo-2-désoxy, par exemple 7.34. En revanche, le couplage des bromures 7.32 ou 7.33 en présence de carbonate d'argent donne le glycoside fi de la façon attendue. On élimine facilement l'halogène dans tous ces composés par voie radicalaire et on arrive ainsi aux sucres 2-désoxy. La méthoxymercuration de 7.29 ou 7.30 avec l'acétate mercurique dans le méthanol fabrique une liaison carbone-mercure. Le triacétylglucal 7.29 donne, après remplacement de l'acétate ionique par du chlore, le glycoside [3 7.35, mélangé à son isomère a-D-manno (les deux produits sont trans-1,2). Le D-glucal libre donne le méthyl 2-acétoxymercuri-2-déoxy-a-D-mannopyranoside avec un rendement élevé. La réduction au borohydrure remplace le mercure par de l'hydrogène. Enfin les peracides, qui se comportent en première approximation comme des sources de cations OH+, reconstituent des pyranoses à partir des glycals. Ce peut-être un procédé commode pour inverser la configuration en C(2) d'un sucre. Ainsi, du galactose on passe au D-galactal 7.36, puis, par traitement avec de l'acide perbenzoïque en solution aqueuse, à un mélange de galactose et de talose[111. Ce sucre rare 7.37 est facilement séparable du galactose par cristallisation. Rappelons que l'inversion directe sur C(2) est impossible dans la série du galactose. Pour terminer, rappelons la synthèse des anhydrides de Brigl par époxydation des glycals avec le diméthyldioxirane exposée au paragraphe 3.4. On traitera d'un autre type d'addition, l'azidonitration, au paragraphe 10.3.3
Les composés hydroxyles — eau, alcools, phénols — ne s'additionnent pas sur la double liaison des glycals et de leurs esters en l'absence de catalyseurs acides. En revanche, à une température relativement élevée, ils produisent un déplacement de la fonction acétate en 3 des triacétylglycals, avec migration de la double
«
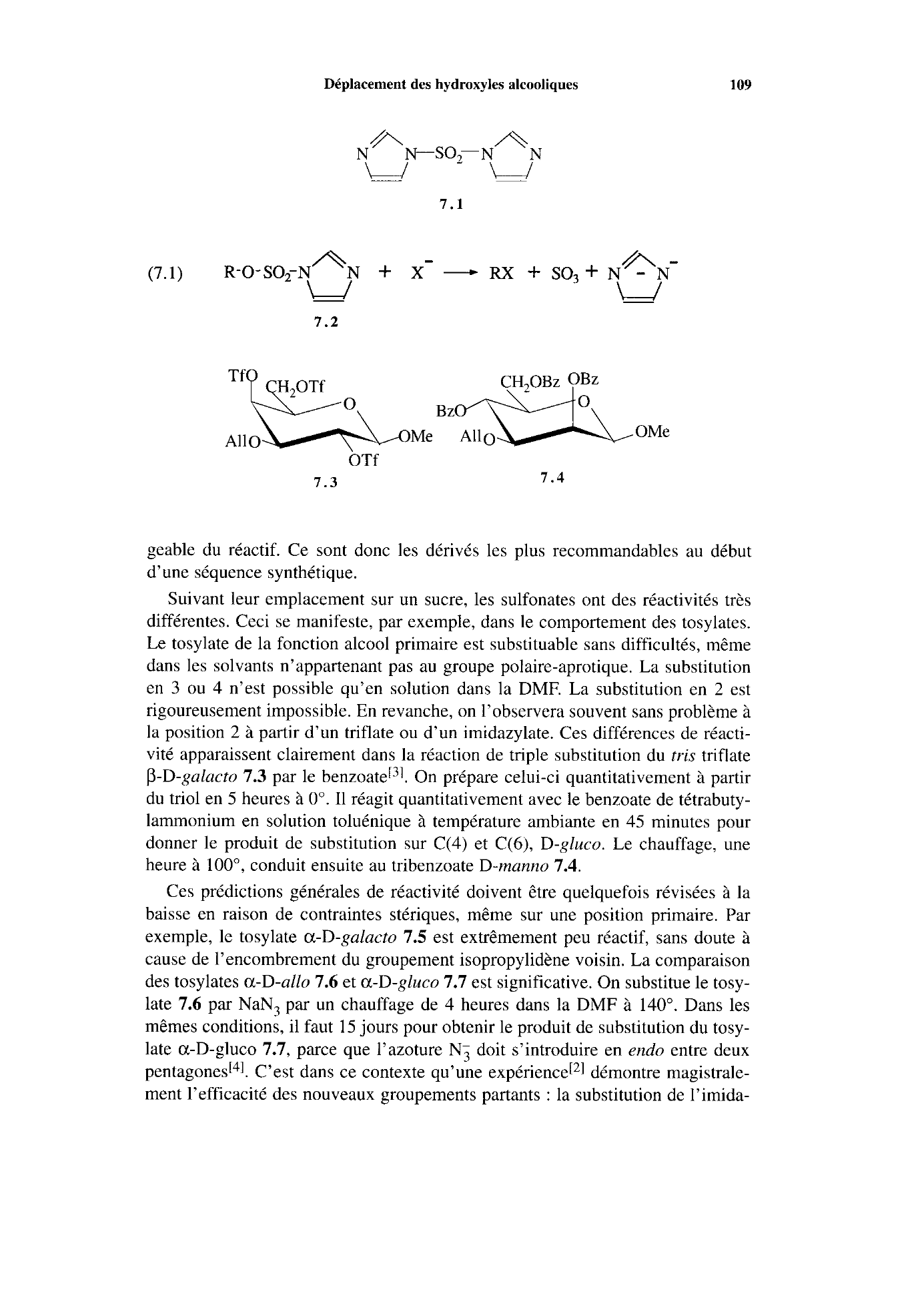
Déplacement des hydroxyles alcooliques 109
7.1
7.2
CH20Bz OBz
Me Al10 OMe All0
OTf
7.3 7.4
geable du réactif.
Ce sont donc les dérivés les plus recommandables au début
d'une séquence synthétique.
Suivant leur emplacement sur un sucre, les sulfonates ont des réactivités très
différentes.
Ceci se manifeste, par exemple, dans le comportement des tosylates.
Le tosylate de la fonction alcool primaire est substituable sans difficultés, même
dans les solvants n'appartenant pas au groupe polaire-aprotique.
La substitution
en
3 ou 4 n'est possible qu'en solution dans la DMF.
La substitution en 2 est
rigoureusement impossible.
En revanche, on l'observera souvent sans problème
à
la position 2 à partir d'un triflate ou d'un imidazylate.
Ces différences de réacti-
vité apparaissent clairement dans la réaction de triple substitution du
tris triflate
P-D-galacto
7.3 par le benzoateF31.
On prépare celui-ci quantitativement à partir
du triol en
5 heures à O".
Il réagit quantitativement avec le benzoate de tétrabuty-
lammonium en solution toluénique
à température ambiante en 45 minutes pour
donner le produit de substitution sur C(4) et
C(6), D-gluco.
Le chauffage, une
heure
à loo", conduit ensuite au tribenzoate D-manno 7.4.
Ces prédictions générales de réactivité doivent être quelquefois révisées à la
baisse en raison de contraintes stériques, même sur une position primaire.
Par
exemple,
le tosylate a-D-galacto 7.5 est extrêmement peu réactif, sans doute à
cause de l'encombrement du groupement isopropylidène voisin.
La comparaison
des tosylates a-D-do
7.6 et a-D-gluco 7.7 est significative.
On substitue le tosy-
late
7.6 par NaN3 par un chauffage de 4 heures dans la DMF à 140".
Dans les
mêmes conditions, il faut
15 jours pour obtenir le produit de substitution du tosy-
late a-D-gluco
7.7, parce que I'azoture Nj doit s'introduire en endo entre deux
pentagones[4].
C'est dans ce contexte qu'une expérience[2] démontre magistrale-
ment l'efficacité des nouveaux groupements partants
: la substitution de l'imida-.
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- LES CHANGEMENTS SIGNIFICATIFS D’HABITUDE ALIMENTAIRE EN RELATION AVEC LE DEVELOPPEMENT DES MALADIES NUTRITIONNELLES AU BENIN ET DANS LE MONDE
- DISCOURS SUR LES RÉVOLUTIONS DE LA SURFACE DU GLOBE, ET SUR LES CHANGEMENTS QU’ELLES ONT PRODUITS DANS LE RÈGNE ANIMAL, 1812. Georges Cuvier
- Comment expliquez-vous que la conscience de notre identité personnelle se maintienne à travers tous les changements auxquels nous sommes soumis?
- On dit communément que l'art épistolaire se perd. Montrez, en com¬parant les moeurs actuelles à celles du passé, quels changements peu¬vent expliquer la différence du rôle de la correspondance aujourd'hui et autrefois.
- Etats de la matière et changements d'états Récapitulatif Synthèse construite par Sylvain sylvain.