DÉTERMINATION D’UNE CHALEUR MOLAIRE DE FORMATION RÉSULTATS
Publié le 20/11/2022

Extrait du document
«
DÉTERMINATION D’UNE CHALEUR MOLAIRE DE FORMATION
RÉSULTATS
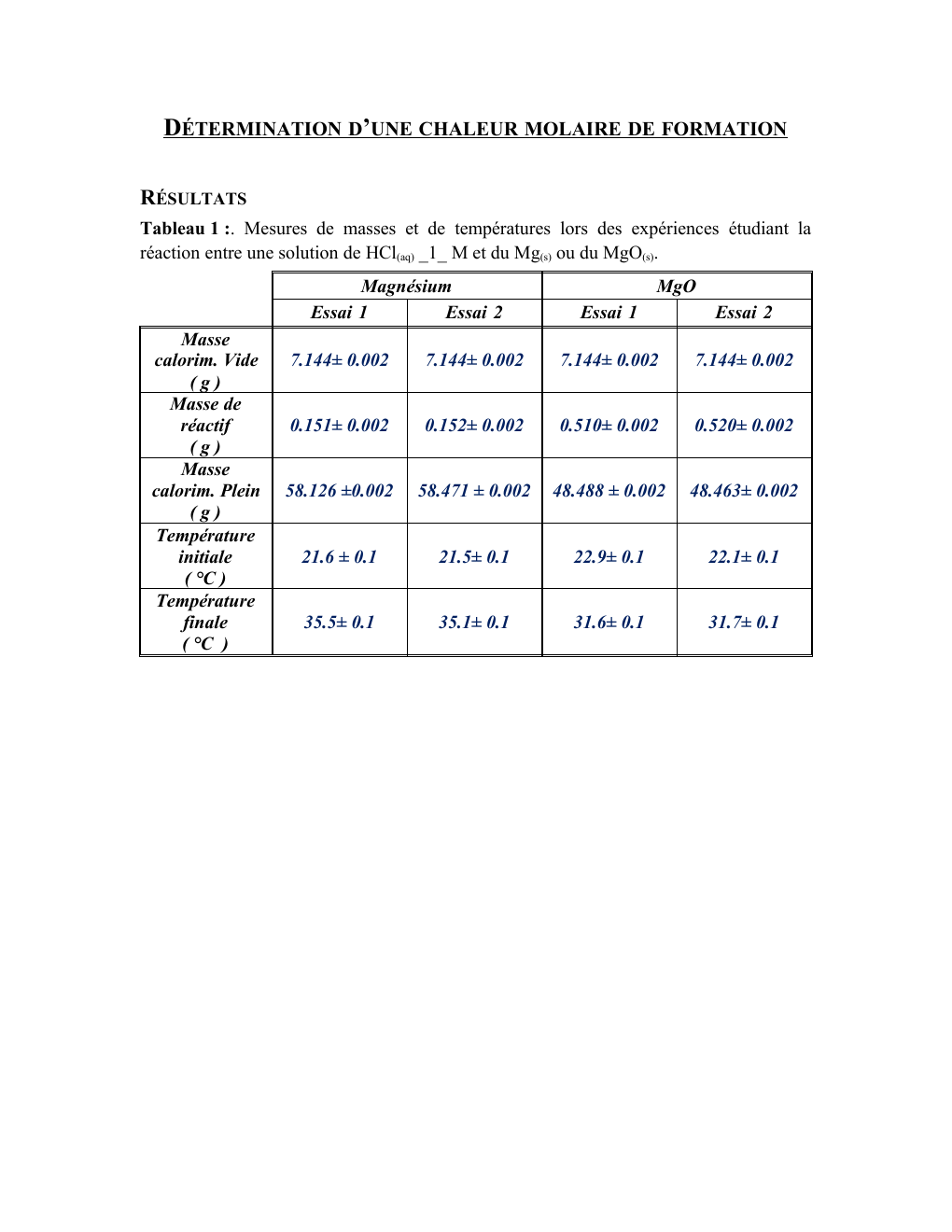
Tableau 1 :.
Mesures de masses et de températures lors des expériences étudiant la
réaction entre une solution de HCl(aq) _1_ M et du Mg(s) ou du MgO(s).
Magnésium
Essai 1
Essai 2
Masse
calorim.
Vide
(g)
Masse de
réactif
(g)
Masse
calorim.
Plein
(g)
Température
initiale
( °C )
Température
finale
( °C )
MgO
Essai 1
Essai 2
7.144± 0.002
7.144± 0.002
7.144± 0.002
7.144± 0.002
0.151± 0.002
0.152± 0.002
0.510± 0.002
0.520± 0.002
58.126 ±0.002
58.471 ± 0.002
48.488 ± 0.002
48.463± 0.002
21.6 ± 0.1
21.5± 0.1
22.9± 0.1
22.1± 0.1
35.5± 0.1
35.1± 0.1
31.6± 0.1
31.7± 0.1
RÉACTIONS
Montrez comment obtenir la réaction globale à partir des réactions 1 à 3 du protocole.
(1)
Mg (s) + 2 HCl (aq)→ MgCl2 (aq) + H2 (g)
(2)
MgCl2 (aq)+ H2O (l)→ MgO (S) + 2 HCl (aq)
(3)
H2 (g) + ½ O2 (g) → H2O (l)
(globale)
Mg (S) + ½ O2 (g) → MgO (S)
ÉNERGIES
Montrer comment relier mathématiquement l’énergie de la réaction globale de formation
du MgO(s) (H0f) aux énergies des réactions 1 à 3 (Hrx).
Mg (s) + 2 HCl (aq) → MgCl2 (aq) + H2 (g)
(H= -446,003kJ/mol)
MgCl2 (aq)+ H2O (l)→ MgO (S) + 2 HCl (aq)
(H = 110,524 kJ/mol)
H2 (g) + ½ O2 (g) →H2O (l)
(H= -285,8 kJ/mol)
Mg (S) + ½ O2 (g) → MgO (S)
(H= -621,2 kJ/moI)
H0(finale) = (H 1)
(Mathématiquement)
-621,258kJ/mol
285,8kJ/mol
=
+
(H
-446,003
2
+
)
+
(H
3)
→
(-(-110,524kJ/mol))
-
Tableau 2 : Enthalpies molaires de formation du MgCl2(aq) formé à partir du Mg ou du
MgO et déterminées à l’aide des valeurs expérimentales du tableau 1.
Masse de la solution
(g)
T
(°C)
Q Solution
( J)
Q réaction
( J )
Moles de réactif
( mol )
Enthalpie molaire de
réaction
( J/mol )
Enthalpie molaire
moyenne de réaction
( J/ mol )
Magnésium
Essai 1
Essai 2
Essai 1
MgO
Essai 2
50,83 ± 0,01
51,17 ± 0,01
40,83 ± 0,01
40,80 ± 0,01
13,9 ± 0,2
13,6 ± 0,2
8,7 ± 0,2
9,6 ± 0,2
2 769,679
2 727,975
1 392,603
1 535,386
- 2 769,679
- 2 727,975
- 1 392,603
- 1 535,386
2,09
9,10
1,01
1,01
- 439 287,44
- 110 524,02
- 121 856,03
- 446 003,08
DH1
- 442 645,26
DH2
- 116 190,025
Tableau 3 : Comparaison des valeurs expérimentales et de la littérature pour la chaleur
molaire de formation du MgO(s).
ΔHf MgO, expérimental
( kJ/ mol )
ΔHf MgO, littérature
( kJ/mol )
% écart
-621.258
(calcul:ΔHf MgO = -446,003+(-(-110,524))285,8)
-621,2
1,03%
Discussion
1) Justifiez le choix de la valeur de capacité calorifique massique utilisée dans vos
calculs, dans le contexte des réactions que vous avez effectuées.
La capacité thermique q u'on a utilisé dans nos calculs a été donné puisque
cette valeur donnée n'est pas une valeur que nous pouvons déterminer
nous-même.
C’est une propriété caractéristique.
Donc, ce n'était pas notre
choix, mais c'était une valeur déterminée par rapport à la capacité précise
des substances qu'on a utilisé d’absorber ou dégager la chaleur.
2) Commentez votre valeur de DHf du MgO(s) sans oublier de rappeler la valeur
attendue et le pourcentage d’écart entre les deux valeurs.
Quel instrument de
mesure a eu le plus d’influence sur l’incertitude de le DHf MgO ? (Indice : Incertitudes
relatives)
L’instrument qui....
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- devoir laboratoire physique chaleur massique
- La formation outil de développement des compétences
- Grille des résultats des auto-dictées des reconstitutions de textes Ou des
- détermination du sexe d'un embryon
- Winnicott, Collected Paper (extrait) Pédiatre avant de se tourner vers la psychanalyse, Donalds Woods Winnicott a étudié tout au long de sa vie le développement affectif et la formation de la personnalité de l'enfant.