RAPPORT DE LABORATOIRE : Étude des solubilités
Publié le 04/04/2012

Extrait du document
Dans la molécule d’octanol, malgré le fait qu’il y ait présence de ponts hydrogènes, l’interaction la plus importante reste les forces de dispersion de London. Cela s’explique par le fait que la chaîne carbonée est beaucoup plus longue que le groupement alcool. Dans l’hexane les seules forces présentes sont les forces de dispersion de London, puisqu’il s’agit d’une molécule non-polaire. Lorsqu’on mélange l’octanol et l’hexane, le ΔH < 0, car les deux molécules doivent briser des forces de dispersion de London pour ensuite en reformer. Les deux molécules sont donc gagnantes et c’est pourquoi l’octanol est soluble dans l’hexane. Puisqu’il y a solubilisation, ΔS > 0 et leur taille est similaire ce qui favorise aussi la solubilisation.
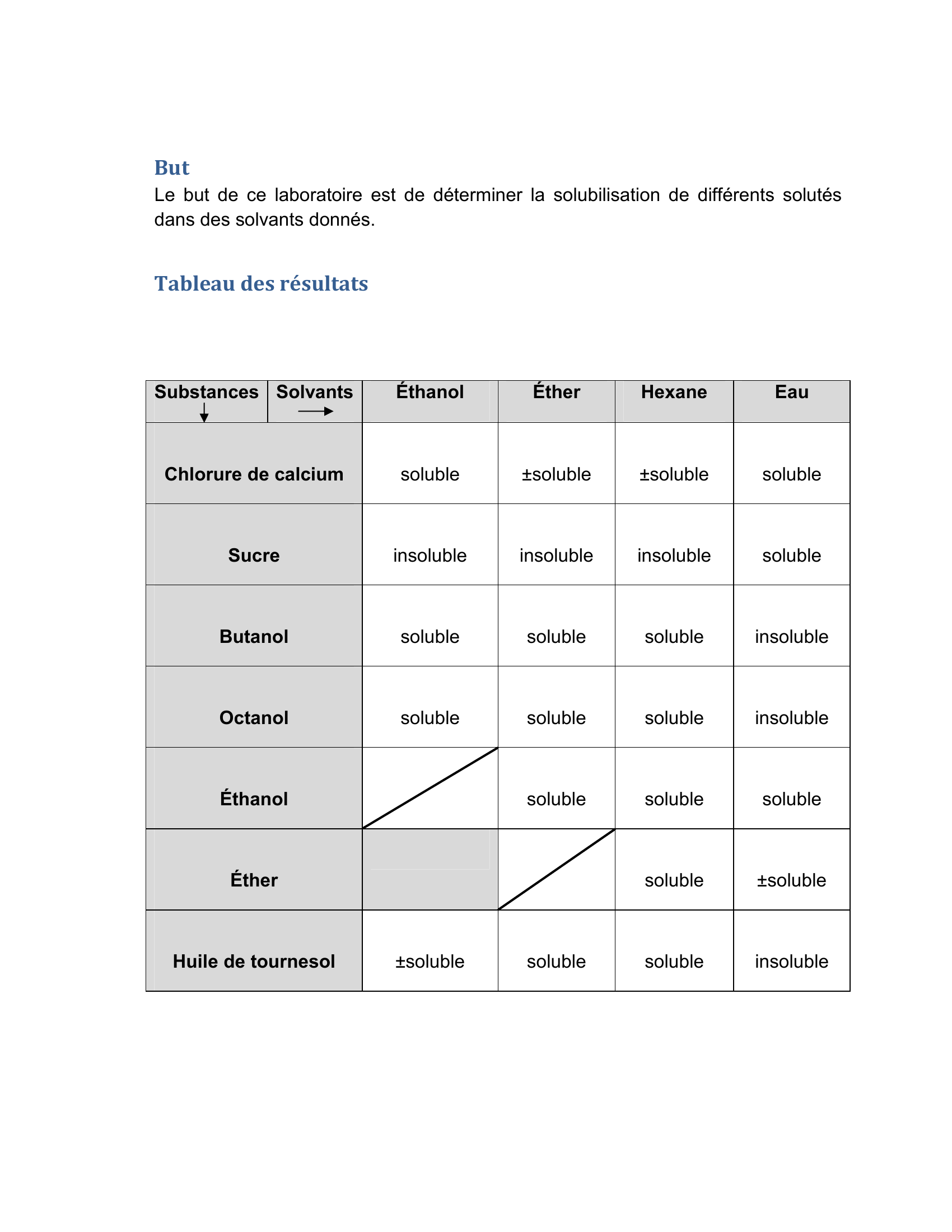
« But Le but de ce laboratoire est de déterminer la solubilisation de différents solutés dans des solvants donnés. Tableau des résultats Substances Solvants Éthanol Éther Hexane Eau Chlorure de calcium soluble ±soluble ±soluble soluble Sucre insoluble insoluble insoluble soluble Butanol soluble soluble soluble insoluble Octanol soluble soluble soluble insoluble Éthanol soluble soluble soluble Éther soluble ±soluble Huile de tournesol ±soluble soluble soluble insoluble. »
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Rapport de laboratoire Chimie
- Rapport : Laboratoire médical
- LABORATOIRE D'OCÉANOGRAPHIE Près des trois quarts de la surface de notre planète (71 %) sont recouverts par la mer, mais ce n'est qu'à une époque récente que la science s'est consacrée à l'étude approfondie de ce milieu riche et complexe.
- LABORATOIRE DE MÉTÉOROLOGIE L'étude et la prévision des phénomènes météorologiques sont difficiles à établir, car le système des perturbations atmosphériques et des courants marins est complexe, et dépend de très nombreux facteurs.
- Rapport de laboratoire