Rapport de laboratoire Chimie
Publié le 11/04/2014

Extrait du document


«
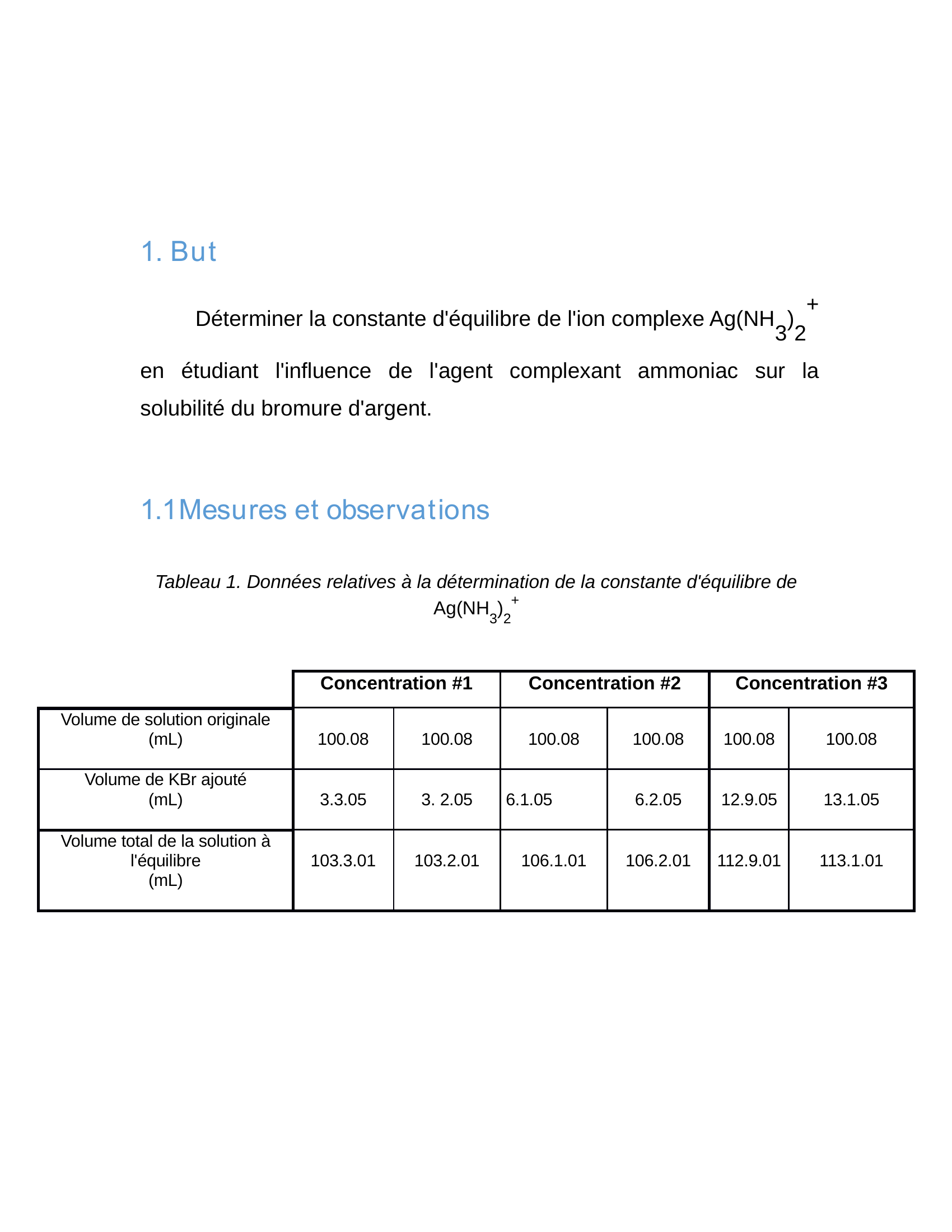
1.
B u t
Déterminer la constante d'équilibre de l'ion complexe Ag(NH
3 )
2 +
en étudiant l'influence de l'agent complexant ammoniac sur la
solubilité du bromure d'argent.
1.1Mesu res et observa t ions
Tableau 1.
Données relatives à la détermination de la constante d'équilibre de
Ag(NH
3 )
2 +
Concentration #1 Concentration #2 Concentration #3
Volume de solution originale
(mL) 100.08 100.08 100.08 100.08 100.08 100.08
Volume de KBr ajouté
(mL)
3.3.05 3.
2.05 6.1.05 6.2.05 12.9.05 13.1.05
Volume total de la solution à
l'équilibre
(mL)
103.3.01 103.2.01 106.1.01 106.2.01 112.9.01 113.1.01.
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- 16/09/2011 Jean-Claude Gesquiere Laboratoire de Chimie Organique Faculté de Pharmacie Inserm U761 Biostructures et Découverte
- Rapport : Laboratoire médical
- LABORATOIRE DE CHIMIE La chimie étudie la composition, la structure, les propriétés et les réactions de transformation possibles des espèces chimiques, naturelles ou artificielles.
- Rapport de laboratoire
- RAPPORT DE LABORATOIRE : Étude des solubilités