cours atomistique
Publié le 07/12/2012
Extrait du document
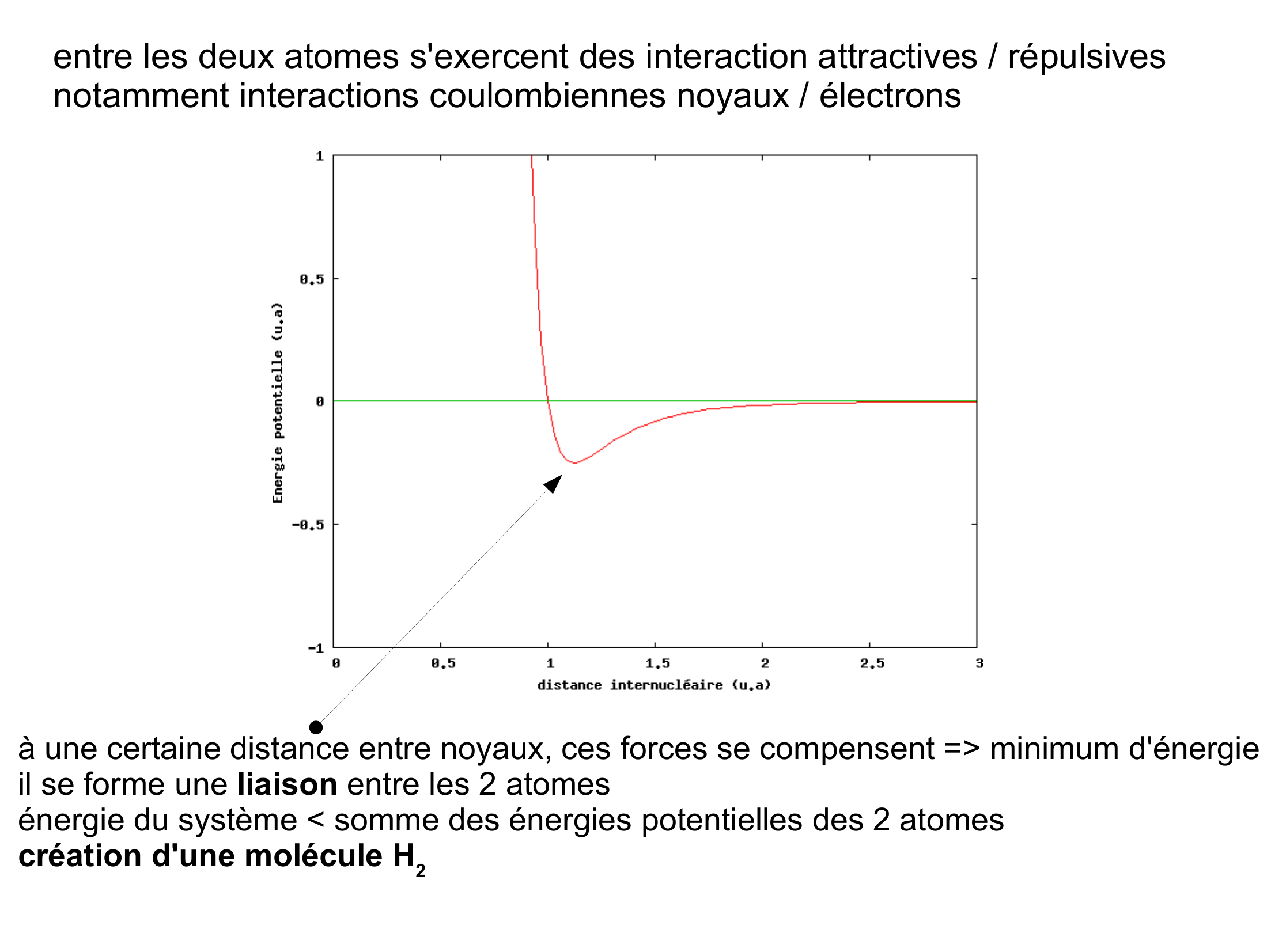
La liaison chimique : formation des molécules variation de l'énergie potentielle, lorsque l'on fait varier la distance entre 2 atomes d''hydrogène courtes distances : interaction répulsive grandes distances interaction négligeable interaction attractive entre les deux atomes s'exercent des interaction attractives / répulsives notamment interactions coulombiennes noyaux / électrons à une certaine distance entre noyaux, ces forces se compensent => minimum d'énergie il se forme une liaison entre les 2 atomes énergie du système < somme des énergies potentielles des 2 atomes création d'une molécule H2 Liaison chimique : modèle de Lewis La liaison entre les 2 atomes est assurée par 2 électrons qui attirent les noyaux et les maintiennent dans une position d'équilibre H· --> <-- ·H ==> H:H pour la molécule de H2 distance d'équilibre entre noyaux r0 = 0,74 Å énergie de liaison E=-436 kJ.mol-1 = -5,4eV ==> H--H il faudra fournir 5.4 eV à la molécule pour la dissocier La liaison est assurée par 2 électrons mis en commun par les deux atomes leurs spins sont opposés Modèle simpliste ==> description quantique de la molécule Description quantique de la liaison chimique : orbitales moléculaires Même concept que pour les atomes : les orbitales atomiques (OA) sont remplacées par les orbitales moléculaires (OM) chacune correspond à un état quantique d'un électron lié à 2 noyaux comme pour les OA, on ne peut avoir qu'un électron dans un état quantique ==> 1 OM contient au maximum 2 électrons appariés formation d'une liaison entre deux atomes X et Y transformation de deux orbitales atomiques ( 1 X et 1 Y) en deux orbitales moléculaires partagées pour résoudre le problème, on utilise l'équation de Scrhödinger comme pour les atomes. Les solutions seront les orbitales moléculaires. Problème : on ne sait résoudre cette équation que pour 1 électron. Pour les systèmes plus complexes, on utilise une résolution approximative : la combinaison linéaire d'orbitales atomiques Méthode LCAO Linear Combination of Atomic Orbitals Principe : Les solutions ? de l'équation de Schrödinger pour une molécule A-B sont des combinaisons linéaires des orbitales atomiques correspondant aux électrons de valence des atomes A et B séparés ? = C A ? A? C B ? B Les coefficients CA et CB doivent satisfaire à deux conditions : l'énergie associée à la fonction d'onde doit être minimale la probabilité de trouver l'électron dans l'espace doit être égale à 1 => la fonction ? est normée (comme les OA) LCAO : molécule de H2 HA r HB appliquons la méthode aux orbitales ?1SA et ?1SB . Les fonctions d'ondes de la molécule H2 s'écriront ? =C A ?1SA ?C B ?1SB il y a d...
« entre les deux atomes s'exercent des interaction attractives / répulsives notamment interactions coulombiennes noyaux / électrons à une certaine distance entre noyaux, ces forces se compensent => minimum d'énergie il se forme une liaison entre les 2 atomes énergie du système < somme des énergies potentielles des 2 atomes création d'une molécule H 2. »
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Université Pierre et Marie Curie PCEM 1 CHU Saint-Antoine CHU Pitié-Salpêtrière Support de cours CHIMIE GENERALE CHAPITRE I - ATOMISTIQUE Professeur Antoine GEDEON Professeur Ariel de KOZAK Support mis à jour en septembre 2004 1 CHAPITRE I : ATOMISTIQUE 1.
- Cours d'histoire-géographie 2nd
- Séance 3 : Quelques rencontres fatidiques : un thème littéraire Cours complet
- Cours sur l'art (références)
- La mondialisation 'HGGSP' - cours