Transformations chimiques et synthèse des oligosaccharides
Publié le 30/05/2015

Extrait du document
10.4.2 Généralisation
Le paragraphe précédent nous a permis de voir les données essentielles des couplages avec les transférases.
5 fois plus grande sur le chitobiose, GlcNAc (1-4)-G1cNAc que sur GlcNAc.
En plus de la galactosyl transférase du colostrum, sept autres transférases ont été clonées et peuvent donc être obtenues à partir de cellules en culture. Le coût de ces enzymes restera sans doute pour un certain temps assez élevé, reflétant la longueur de la mise au point du clonage. En fait, on peut réaliser des synthèses efficaces avec des préparations enzymatiques partiellement purifiées extraites d'organes de mammifère (foie, rein, cerveau) achetés dans une boucherie.
«
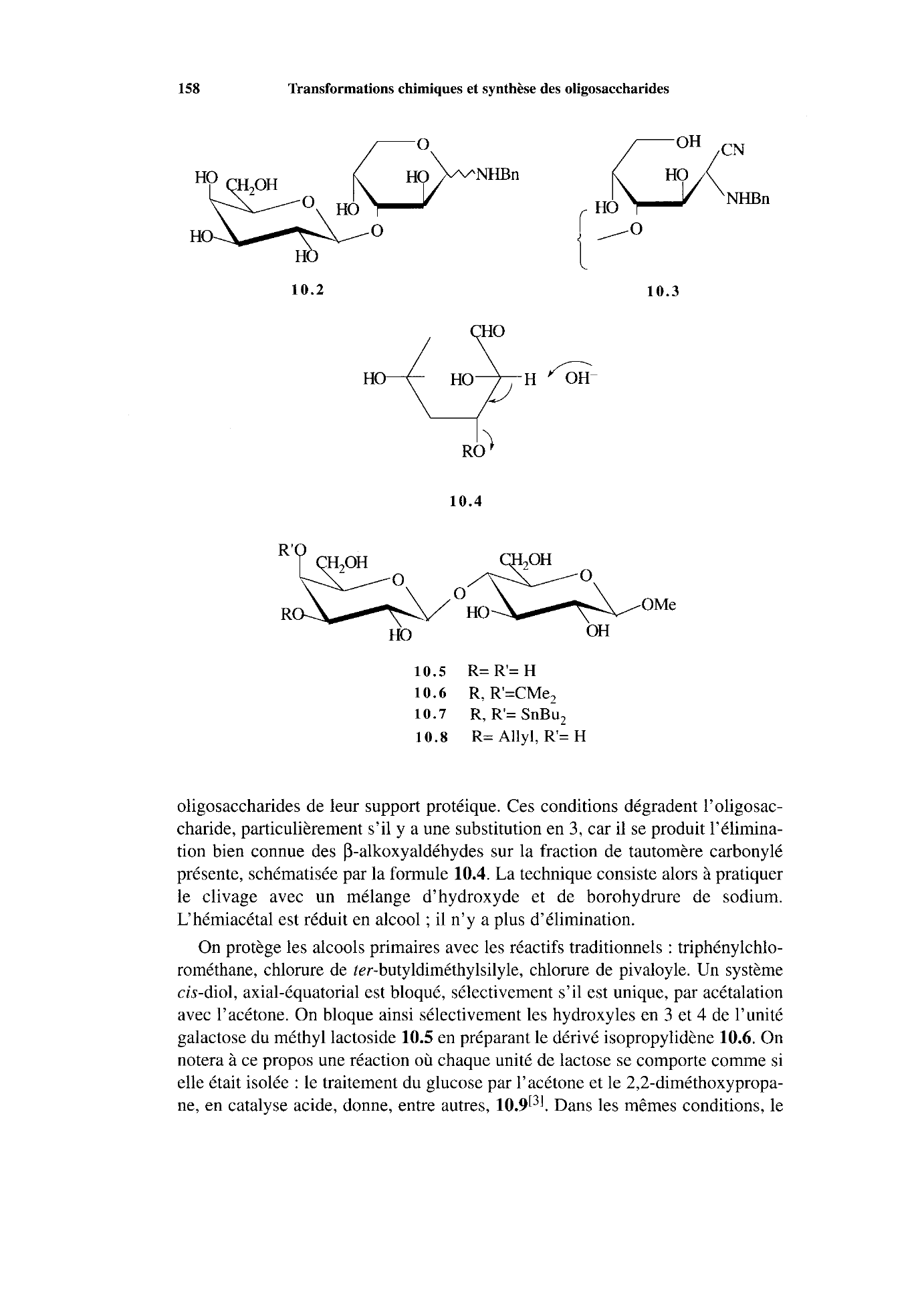
158 Transformations chimiques et synthèse des oligosaccharides
10.2 10.3
RO
10.4
HO
10.5 R=R=H
1 O.
6 R, R’=CMe,
10.7 R, R’= SnBuz
10.8 R= Allyl, R= H
oligosaccharides de leur support protéique.
Ces conditions dégradent l’oligosac-
charide, particulièrement s’il y
a une substitution en 3, car il se produit l’élimina-
tion bien connue des P-alkoxyaldéhydes sur la fraction de tautomère carbonylé
présente, schématisée par la formule
10.4.
La technique consiste alors à pratiquer
le clivage avec un mélange d’hydroxyde et de borohydrure de sodium.
L‘hémiacétal est réduit en alcool
; il n’y a plus d’élimination.
On protège les alcools primaires avec les réactifs traditionnels : triphénylchlo-
rométhane, chlorure de
ter-butyldiméthylsilyle, chlorure de pivaloyle.
Un système
cis-diol, axial-équatorial est bloqué, sélectivement s’il est unique, par acétalation
avec l’acétone.
On bloque ainsi sélectivement les hydroxyles en
3 et 4 de l’unité
galactose du méthyl lactoside
10.5 en préparant le dérivé isopropylidène 10.6.
On
notera
à ce propos une réaction où chaque unité de lactose se comporte comme si
elle était isolée
: le traitement du glucose par l’acétone et le 2,2-diméthoxypropa-
ne, en catalyse acide, donne, entre autres,
10.9[31.
Dans les mêmes conditions, le.
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- sucre, métabolisme du 1 PRÉSENTATION sucre, métabolisme du, ensemble des réactions chimiques de synthèse et de dégradation du sucre dans un organisme.
- four industriel four industriel, tout type d'appareil utilisé pour soumettre une substance à la chaleur dans le but de lui faire subir des transformations physiques ou chimiques.
- Document de synthèse Méthodes contraceptives
- Synthèse : extrait 5 "Supplément au voyage de Bougainville" de Diderot
- Thème : Constitution et transformations de la matière