Les Hydrocarbures Composés uniquement de Carbone et d'Hydrogène (CxHy) On distingue plusieurs types : alcanes : ne contiennent que des liaisons simples entre les atomes de carbone.
Publié le 26/02/2014

Extrait du document
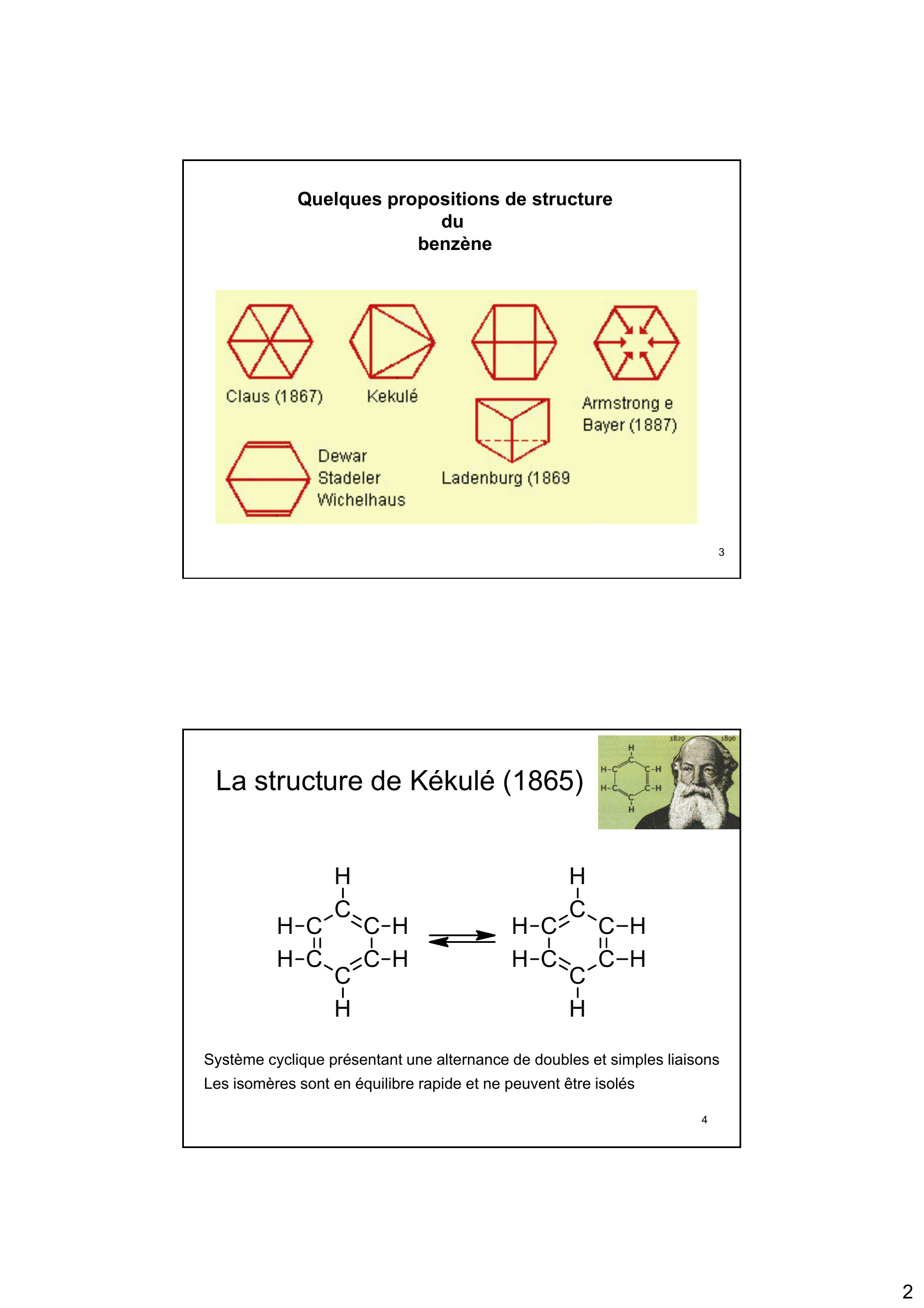
Les Hydrocarbures Composés uniquement de Carbone et d'Hydrogène (CxHy) On distingue plusieurs types : alcanes : ne contiennent que des liaisons simples entre les atomes de carbone. peuvent être cycliques : cyclanes alcènes : contiennent au moins une double liaison Carbone-Carbone alcynes : contiennent au moins une triple liaison Carbone-Carbone hydrocarbures aromatiques 1 BENZÈNE et AROMATICITÉ C6H6 2 1 Quelques propositions de structure du benzène 3 La structure de Kékulé (1865) HC HC H C C H CH CH HC HC H C C H CH CH Système cyclique présentant une alternance de doubles et simples liaisons Les isomères sont en équilibre rapide et ne peuvent être isolés 4 2 Il est possible d'écrire deux structures en résonance ( ou structures mésomères) de la molécule de benzène. H H H H H H L'hybride de résonance est beaucoup plus stable que les deux formes mésomères Les 6 électrons délocalisés peuvent être représentés par un cercle L'aromaticité stabilise le benzène de 150 kJ par rapport à un hypothétique cyclohexatriène 5 Il est possible d'écrire deux structures en résonance ( ou structures mésomères) de la molécule de benzène. H H H H H H L'hybride de résonance est beaucoup plus stable que les deux formes mésomères Les 6 électrons délocalisés peuvent être représentés par un cercle L'aromaticité stabilise le benzène de 150 kJ par rapport à un hypothétique cyclohexatriène 6 3 R + C Cl C H R H C H C Cl + H + CH2 CH CH2 H H + CH2 CH CH2 7 Règles pour évaluer la stabilité relative des structures en résonance/formes mésomères Les structures en résonances contenant le plus grand nombre de liaisons covalentes sont les plus stables et donc ont donc la contribution la plus importante. Mésomère le plus stable Les structures en résonance pour lesquelles tous les atomes ont des couches de valence complètes sont les plus stables Carbone environné de 6 électrons Carbone environné de 8 électrons 8 4 théorique = 3 x - 120 kJ = - 360 kJ Énergie Potentielle Énergie de résonance (stabilisation) = 152 kJ 9 Structure du Benzène 1,39 A 1,09 A 10 5 2-D/ Aromaticité et Orbitales Moléculaires 11 La formation du squelette ? amène en position de recouvrement latéral des 6 orbitales 2p et conduit à la formation de 6 orbitales moléculaires 12 6 - + - + - - - + + + + + + + + + + 13 Structure électronique : Orbitales Moléculaires OM antiliantes Énergie Six orbitales 2p Contiennent six électrons OM liantes Énergie de résonance (stabilisation) = 152 kJ 14 7 Aromaticité : Règle de Huckel Pour qu'un composé soit aromatique, il faut : Un système cyclique plan Chaque atome du cycle doit posséder une orbitale p assurant un domaine continu de circulation des électrons Le nombre d'électrons délocalisés doit correspondre à 4n+2 (n étant un nombre entier). 15 Règle de Huckel cyclobutadiène benzène cyclooctatétraène cyclodécapentaène 4 el. ? 6 el. ? 8 el. ? 10 el. ? naphtalène anthracène 10 el. ? el 14 el. ? el
« 2 Quelques propositions de structure du benzène 3 La structure de Kékulé (1865) H H C C C C C CH H H H H H C C C C C CH H H H H H 4 Système cyclique présentant une alternance de doubles et simples liaisons Les isomères sont en équilibre rapide et ne peuvent être isolés H H. »
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- 07/11/2011 Les dérivés Carbonylés H,C C O H,C 1 Nomenclature CO Groupement carbonyle : CO lié uniquement à C ou H O Les aldéhydes C H Au moins un des deux substituants est un atome d'Hydrogène Groupement principal : suffixe al, ou carbaldéhyde pour des molécules complexes H CHO H3C CHO Méthanal (ou aldéhyde formique ou formaldéhyde) (la solution aqueuse à 40% = formol) Éthanal ( ou aldéhyde acétique ou acétaldéhyde) CHO Cyclohexane carbaldéhyde Groupement secondaire
- glucides glucides, composés organiques naturels ou artificiels dans lesquels l'hydrogène et l'oxygène sont combinés avec le carbone.
- albumine albumine, groupe de protéines simples constituées de carbone, d'hydrogène, d'oxygène, d'azote et d'un petit pourcentage de soufre.
- LIAISONS COVALENTES ORBITALES MOLECULAIRES La formation d'une liaison entre deux atomes n'a qu'un but: les stabiliser.
- poussières cosmiques, grains de quelques centièmes de micromètre, qui, avec des atomes essentiellement d'hydrogène et des molécules, peuplent le milieu interstellaire.