Couple acide-base. Dosage de l'acide acétique d'un vinaigre
Publié le 17/11/2014

Extrait du document
Partie A. Couple acide-base
L'acide acétique (ou éthanoïque) est un acide faible.
1. Écrire l'équation-bilan de la réaction de cet acide avec l'eau. Préciser les couples acide-base intervenant dans cette réaction.
2. Donner l'expression de la constante d'acidité Ka du couple acide-base correspondant à l'acide acétique en fonction de la concentration des espèces en solution.
3. On mélange une solution d'acide acétique et une solution d'acétate de
sodium. Le pH de la solution obtenu est égal à 6,5.
Préciser l'espèce chimique prédominante du couple acide-base présente
dans la solution finale. Justifier.
On donne pKa = 4,8.
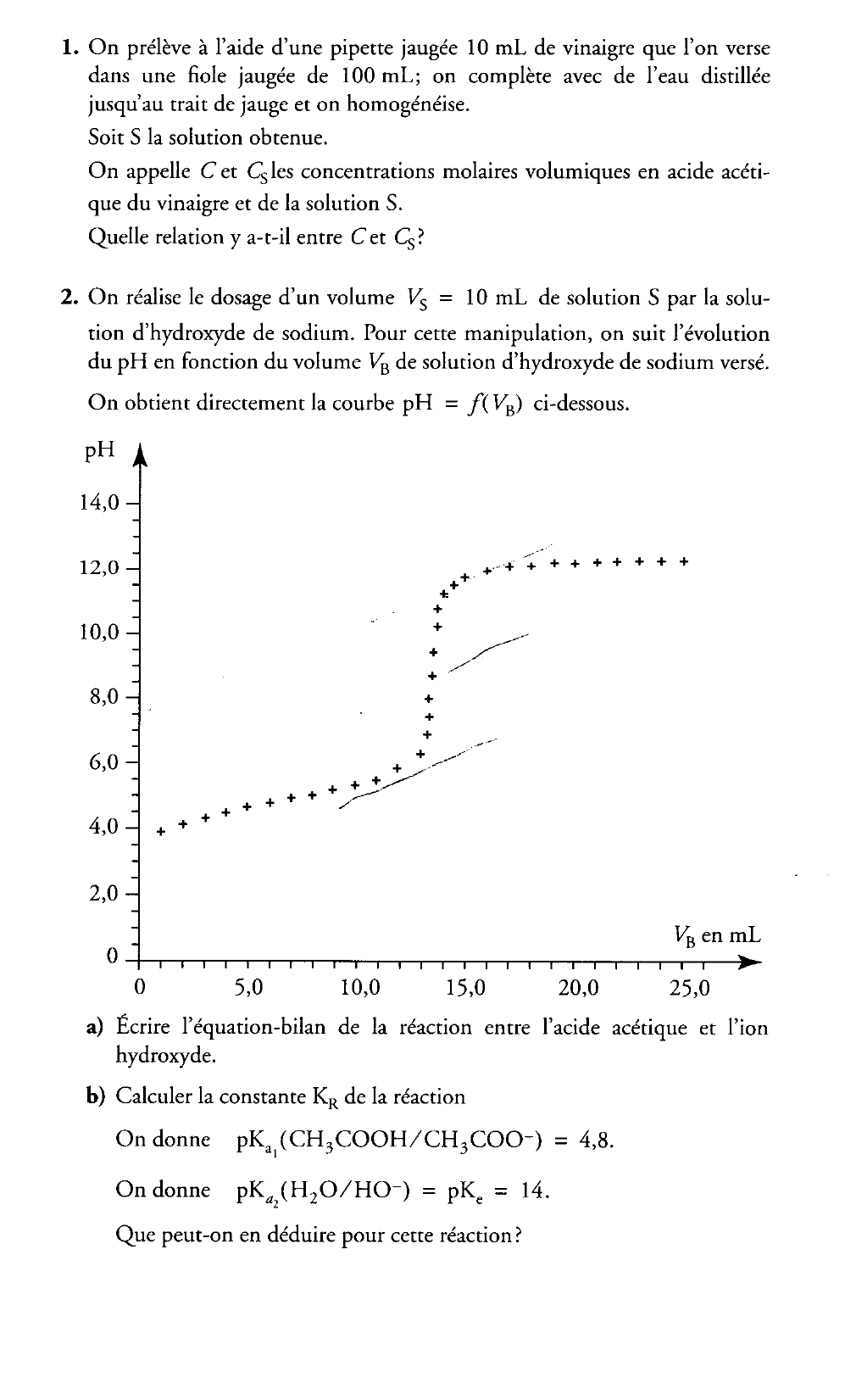
Partie B. Dosage de l'acide acétique d'un vinaigre
Le degré d'acidité d'un vinaigre est la masse en grammes d'acide acétique pur contenu dans 100 g de vinaigre.
On se propose de déterminer le degré d'un vinaigre du commerce en dosant une solution diluée de ce vinaigre par une solution aqueuse d'hydroxyde de sodium (soude) de concentration CB = 0,10 mol • L-1.
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- couple acide base
- Locutions avec acide, nom masculin acide acétique [CHIMIE] Acide du vinaigre de formule CH3CO2H.
- Etude quantitative du couple acide acétique /ion acétate
- 07/11/2011 Acides aminés et dérivés Définition : Dérivés bifonctionnels - fonction acide carboxylique - fonction amine Seulement 20 (21) amino acides naturels entrent dans la composition des protéines, traduits du code génétique supporté par les acides nucléiques Dans certains cas, des acides aminés pourront - après formation de la protéine - subir des modifications dites post translationnelles La composition en AA des protéines matures est donc un peu plus complexe 1 Structure
- 07/11/2011 Les dérivés Carbonylés H,C C O H,C 1 Nomenclature CO Groupement carbonyle : CO lié uniquement à C ou H O Les aldéhydes C H Au moins un des deux substituants est un atome d'Hydrogène Groupement principal : suffixe al, ou carbaldéhyde pour des molécules complexes H CHO H3C CHO Méthanal (ou aldéhyde formique ou formaldéhyde) (la solution aqueuse à 40% = formol) Éthanal ( ou aldéhyde acétique ou acétaldéhyde) CHO Cyclohexane carbaldéhyde Groupement secondaire